








【药品名称】
通用名称:噻托溴铵喷雾剂
英文名称:Tiotropium Bromide Spray
汉语拼音:Saituoxiu’an Penwuji
【成分】噻托溴铵。
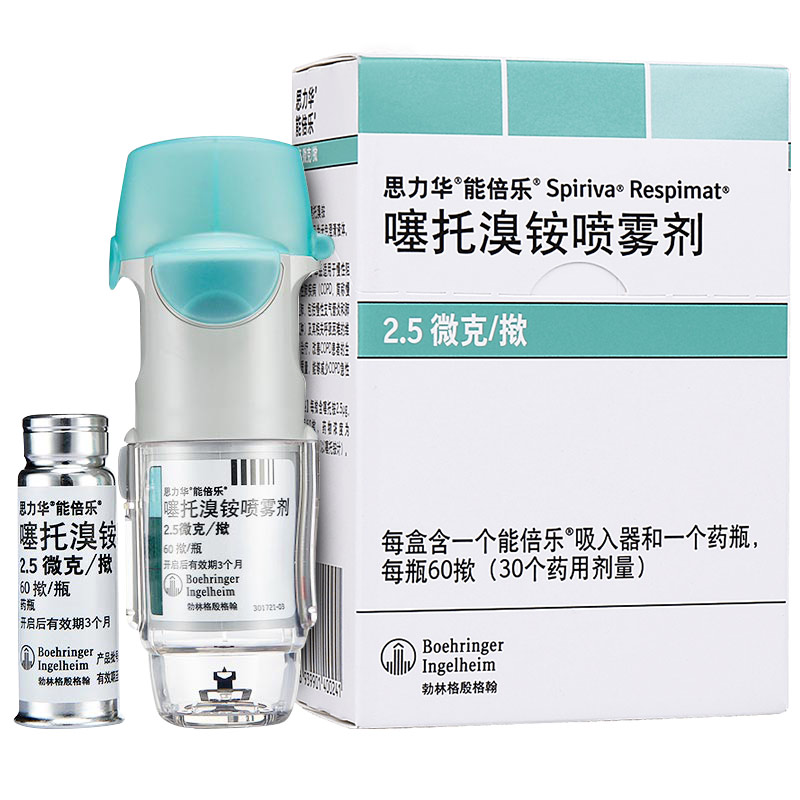
【性状】本品为无色澄清液体,装于铝壳包覆的塑料药瓶中,使用时插入喷雾器中,揿压装置,药液呈雾状喷出。
【适应症】本品适用于慢性阻塞性肺疾病(COPD,包括慢性支气管炎和肺气肿)及其相关呼吸困难的维持治疗,改善COPD患者的生活质量,能够减少COPD急性加重。
【规格】0.22624毫克/毫升(以噻托铵计),每揿含噻托溴铵2.5微克,每瓶60揿,每2揿为1剂量单位。
【用法用量】本品只能吸入使用。装有噻托溴铵的药瓶只能插入Respimat吸入装置并通过Respimat吸入装置吸入使用(参见使用说明)。
一个药用剂量包含2揿。
成人的推荐剂量是通过Respimat吸入装置每天相同时间吸入一次,每次吸入2揿(参见使用说明)。
不应超过推荐剂量使用本品。
特殊人群:
老年患者可以按推荐剂量使用本品。
伴有肾功能不全患者可以按推荐剂量使用。然而,与其他主要经肾脏排泄的药物一样,对于中到重度肾功能不全患者(肌酐清除率≤50ml/分钟),应对噻托溴铵的应用予以密切监控(参见【注意事项】)。
伴有肝功能不全患者可以按推荐剂量使用噻托溴铵(参见【药代动力学】)。
COPD通常不发生于儿童。有关儿科患者使用本品的安全性与有效性尚无定论。
【不良反应】列出的不良反应中,许多与本品的的抗胆碱能特性有关。
以下列举的不良反应发生频率基于五项持续12周至1年治疗的安慰剂对照临床试验汇总中的噻托溴铵组(2,802名患者)所观察到的药物不良反应(即与噻托溴铵有关的事件)的发生率 。
发生频率定义如下:
十分常见(>1/10);常见(≥1/100到<1/10);偶见(≥1/1,000到<1/100);罕见(≥1/10,000到<1/1,000);十分罕见(<l/10,000);不明确(基于现有数据无法估计)。
发生频率不明确,在2802名患者中未观察到药物不良反应
有关个别严重不良反应和/或频繁发生的不良反应的信息
在对照临床研究中,常见的不良反应为抗胆碱能不良反应,例如口干,发生率约为3.2%。
在五项临床研究中,2,802名接受噻托溴铵治疗的患者中有3人(0.1%)因口干而导致停药。
与抗胆碱能性相关的严重不良反应包括青光眼、便秘、包括麻痹性肠梗阻在内的肠梗阻、尿潴留等。
关于特殊人群的其他信息
抗胆碱能作用可能随着年龄增高而增强。
【禁忌】本品禁用于对噻托溴铵、阿托品或其衍生物(如:异丙托溴铵、氧托溴铵)以及对本品任何辅料过敏的患者。
【注意事项】本品作为一种每日一次维持治疗的支气管扩张剂,不应用于支气管痉挛急性发作的初始治疗,即不应用作抢救治疗药物。
吸入本品药液后可能发生速发型超敏反应。与其他抗胆碱能药物一样,本品应慎用于窄角型青光眼、前列腺增生或膀胱颈梗阻患者。
吸入药物可能会引起吸入性支气管痉挛。
伴有明确心律不齐的患者应当慎用本品。
在伴有中到重度肾功能不全(肌酐清除率≤50ml/min)患者中,血药浓度随肾功能的降低而增高,故在这些患者中,仅应在预期获益超过潜在风险时使用本品。目前尚无重度肾功能不全患者长期使用本品的经验(参见【药代动力学】)。
必须提醒患者避免让药物喷雾进入眼内。应告知患者药物进入眼内可能引发或加重窄角型青光眼、眼睛疼痛或不适、暂时性视力模糊。视觉晕轮或彩色影像并伴有结膜充血引起的红眼和角膜水肿。如果出现任何上述征象,应停用噻托溴铵并立即咨询医疗专业人士。
已经观察到抗胆碱药物治疗中会出现口干症状,长期口干与龋齿可能有关。
本品每日最多使用1次(2揿)(参见【药物过量】)。
本品的药瓶只能和Respimat。吸入装置一起使用。
【孕妇及哺乳期妇女用药】尚无妊娠状态下使用本品的临床资料。动物研究已经显示了与母体毒性有关的生殖毒性(参见【毒理学研究】)。尚不明确人类是否存在上述潜在风险。因此,本品应只在具有明确适应症的情况下用于孕妇。
尚未明确噻托溴铵在人类是否会分泌到乳汁中。尽管针对啮齿类动物的试验显示仅有少量噻托溴铵分泌进入乳汁,但是不推荐在哺乳期使用本品。噻托溴铵是长效化合物。在决定继续或中断哺乳,还是继续或中断本品治疗时,应权衡母乳喂养对婴儿的受益和噻托溴铵治疗对该女性的受益。
【儿童用药】尚没有儿科患者应用噻托溴铵的经验,因此年龄小于18岁的患者不推荐使用本品。参见【用法用量】。
【老年用药】老年患者可以按推荐剂量使用噻托溴铵。参见【用法用量】。
【药物相互作用】尽管未进行过正式的药物相互作用研究,但噻托溴铵吸入性粉末与其它药物同时使用未发现不良反应,这些药物包括拟交感的支气管扩张剂,甲基黄嘌呤、口服或者吸入性甾体类药物等,为通常用于治疗慢性阻塞性肺疾病(COPD)的药物。
噻托溴铵与其它抗胆碱能药物合用未过行过研究,因此不推荐与其它抗胆碱能药物合用。
【药物过量】高剂量的噻托溴铵可能引起抗胆碱能的症状和体征。健康志愿者单次吸入达340微克的噻托溴铵后未出现全身性的抗胆碱能不良作用。
口干/咽喉干燥和鼻粘膜干燥的发生率呈现出剂量依赖性(每天10-40微克)的特点,此外,当健康受试者吸入多达40微克噻托溴铵溶液,用药14天内除了唾液量自第7天以后明显减少以外,未见其他与本药相关的不良反应。在6项长期研究中,COPD患者每天吸入10微克噻托溴铵,用药4至48周,未见明显不良反应。
由于疏忽而经口服入噻托溴铵胶囊引起急性中毒是不太可能的,因其口服生物利用度很低。
【临床试验】III期临床研究包括两项为期1年,两项为期12周,两项为期4周的随机双盲研究,共纳入2,901名COPD患者(其中1038名接受了5微克噻托溴铵的治疗)。其中为期1年的研究计划包括两项安慰剂对照试验。
两项为期12周的临床试验均采用阳性药物(异丙托溴铵)与安慰剂对照。全部6项研究均包含肺功能检测。此外,两项为期1年的研究包含了呼吸困难的健康项目监测,健康相关生活质量以及对急性发作的疗效等内容。
在上述研究中,与安慰剂相比,每天一次吸入噻托溴铵喷雾剂可以在首次使用30分钟内明显改善肺功能(第一秒用力呼气量与用力肺活量)。
肺功能改善效果可以平稳维持24小时。
在一周内可以达到稳定的药效学效果。根据患者每日的测量记录,本品显著改善早晨和夜间的PEFR(呼气峰流速)。与安慰剂对比,应用本品可以减少使用支气管扩张剂急救的次数。
给药期间,噻托溴铵喷雾剂的支气管扩张效果可维持满48周,未见药物耐受表现。
【药理毒理】药理作用
噻托溴铵是一个长效抗胆碱能药物。通过和支气管平滑肌上的毒蕈碱受体结合,噻托溴铵可抑制副交感神经末端所释放的乙酰胆碱的胆碱能(支气管收缩)作用。其对毒蕈碱受体亚型M1~M5有相似的亲和力。在呼吸道中,噻托溴铵竞争性且可逆性的抑制M3受体,可引起平滑肌松弛。此作用呈剂量依赖性,并可持续24小时以上。作用时间长可能是由于其与M3受体解离非常慢。其解离半衰期显著长于异丙托溴铵。作为四价铵抗胆碱能药物,噻托溴铵在吸入给药时是局部(支气管)选择性的,由此可达到治疗效果而不至于产生全身性抗胆碱能作用。其支气管扩张作用基本上是局部性(气道)作用,而非全身性作用。
毒理研究
本品安全药理学常规研究、重复剂量毒理学研究和生殖毒理学研究中观察到的结果均可由噻托溴铵的抗胆碱能特性来解释,特别如动物摄食量下降、体重增加受抑制、口干和鼻干、泪液和唾液分泌减少、瞳孔放大和心率增加等反应。重复剂量毒理学研究中观察到其它有关作用为:大鼠和小鼠的轻度呼吸道刺激反应表现为鼻炎和鼻腔及鼻咽部的上皮改变。大鼠前列腺炎伴随膀胱蛋白沉积和膀胱结石症。
只有在产生母体毒性的剂量水平,才能观察到对妊娠、胚胎/胎儿的发育、分娩或围产期发育的有害作用。
噻托溴铵对大鼠和家兔均无致畸作用。对呼吸道(刺激作用)和尿道(前列腺炎)的作用和生殖毒性只在局部或全身给药剂量超过治疗剂量的5倍以上才观察到。相关研究未发现噻托溴铵有潜在的遗传毒性和致癌性。
【药代动力学】噻托溴铵是略溶于水的非手性四价铵化合物,能够以溶液形式通过吸乳器给药,吸入药量大大约40%分布于靶器官肺。下面所述的药代动力学资料许多是用高于推荐治疗的高剂量得来的。
吸收:
给年轻的健康志愿者吸入药液后,尿液分析显示约33%大吸入药量进入体循环。噻托溴铵的口服溶液的绝对生物利用度只有2~3%。噻托溴铵在吸入5分钟后达到最高血药浓度。由于其四价铵化合物的特性,食物不影响它的吸收。
分布:该药与血浆蛋白结合率达72%,分布容积为32L/kg。在稳态时。COPD患者吸入18微克的干粉后5分钟测得的血药峰浓度为17~19pg/ml,其后以多室模型的方式迅速下降。稳态的血药谷浓度为3~4pg/ml。肺的局部浓度未知,但从给药方式可以看出肺的实际药物浓度较高。对大鼠进行研究表明,噻托溴铵完全不能通过血脑屏障。
生物转化:生物转化的程度非常小,年轻健康志愿者静注药物后有74%的剂量以原型从肾脏排泄,从而证明了这一点。噻托溴铵是酯,经非酶方式分解为醇(N-甲基东莨菪醇)和酸(二噻吩羟基乙酸),二者均不能与毒蕈碱受体结合。
在体外用人肝微粒体和人肝细胞进行的实验表明,一些药物(小于静注剂量的20%)经依赖于细胞色素P450的氧化及随后与谷胱甘肽结合成为各种Ⅱ相代谢物。体外肝微粒体试验表明,这一酶解通路可被CYP 2D6(和3A4)抑制剂、奎尼丁、酮康唑和孕二烯酮抑制。因此CYP 2D6和3A4包含在代谢通路中,参与了较小部分药物的消除。噻托溴铵即使在高于治疗浓度时也不抑制肝微粒体中的细胞色素CYP 1A1、1A2、2B6、2C9、2C19、2D6、2E1或3A。
消除:噻托溴铵的终末消除半衰期在吸入后5和6天之间。年轻健康志愿者静注后总清除率为880ml/min,个体之间变异性为22%。静注给予噻托溴铵后主要以原药的形式经尿液排泄(74%)。
吸入药液后,20.1% - 29.4%的药量经尿液排出,其余主要是在肠道内未被吸收的药物,会随粪便排出。噻托溴铵的肾脏清除率超过了肌酐清除率,表明药物可被分泌进入尿液。COPD患者长期每日一次碾入噻托溴铵后,第7天可达药代动力学稳态,此后没有药物蓄积。
线性/非线性:静注和干粉吸入给药后在治疗范围内,噻托溴铵的药代动力学证明为线性药代动力学。
老年患者:正如所有主要经肾脏排泄的药物一样,老年患者噻托溴铵的肾清除率下降(年龄小于58岁的COPD患者,清除率为326ml/min;年龄大于70岁的COPD患者,清除率为163ml/min)。这可能与肾功能下降有关。噻托溴铵吸入后经尿液的排泄由14%(年轻健康志愿者)下降至约7%(COPD患者),然而,与患者个体之间和个体内变异性(干粉吸入后AUC0-4h增加了43%)相比,COPD患者的血药浓度并没有随年龄的增加而出现显著改变。
肾功能不全患者:与所有其它主要经肾脏排泄的药物相同,肾功能不全时静注或干粉吸入血药浓度均有增加且药物的肾脏清除率下降。在老年人较常见的轻度肾功能不全(CLCR 50-80ml/min),可使噻托溴铵血药浓度轻度增加(静注后AUC0-4h 增加39%)。在中重度肾功能不全的COPD患者(CLCR<50ml/min)。静注给予噻托溴铵后血药浓度加倍(AUC0-4h 增加82%),干粉吸入后的血药浓度亦增加。
肝功能不全患者:肝功能不全对噻托溴铵的药代动力学无影响。噻托溴铵主要经肾脏排泄清除(年轻健康志愿者为74%),少量以非酶酯分解成无药理活性的产物。
【包装】60揿/瓶+1个Respimat吸入装置/盒。
装有药液的药瓶为聚乙烯/聚丙烯材料,配有一个带硅胶密封圈的聚丙烯帽。药瓶被密封于一个铝制圆筒内。
【贮藏】密保存于25℃以下,不得冷冻。
请保存在儿童不易触及的安全之处!
【有效期】36个月(开启后3个月有效)
【批准文号】国药准字J20170023
【生产企业】上海勃林格殷格翰药业有限公司